Enterokokker rapportert som tigesyklinresistente til NORM avkreftes å være tigesyklinresistente
K-res fenotypiske analyser viser at alle de testede blodkulturisolater av Enterococcus faecium og Enterococcus faecalis som er rapportert som resistente i NORM 2019 er følsomme for tigesyklin.
I NORM 2019 og 2020 rapportene hvor 2020 brytningspunkter for tigesyklin ble brukt, var det registrert henholdsvis 4-6% og 4-13% tigesyklinresistens hos enterokokker, mens det i 2018 var < 1%. K-res ønsket å se på hva som kunne være årsaken til denne endringen. Vi ba derfor om tilgang til de fenotypiske dataene fra NORM og til å samle inn et representativt utvalg av NORM 2019 isolatene for å gjøre fenotypiske analyser.
Materiale og metoder
Vi inkluderte NORM 2019 blodkultur isolater som besto av 30 E. faecalis og 9 E. faecium med påvist nedsatt følsomhet for tigesyklin (disk diffusjons soner 16-20 mm for E. faecalis og 18-21 mm for E. faecium) samt 10 E. faecalis og 21 E. faecium som var følsomme for tigesyklin (disk diffusjons soner 21 mm for E. faecalis og 22-23 mm for E. faecium) (Figur 1 og 2). Totalt 70 stammer (E. faecalis n=40 og E. faecium n=30) hvorav 39 hadde påvist nedsatt følsomhet for tigesyklin i NORM-protokollen for 2019.
EUCAST disk diffusjon ble utført med tigesyklin lapper fra Becton-Dickinson (BD) og Oxoid. MIC-bestemmelse ble utført med gradienttester fra Liofilchem (MTS) og bioMerieux (Etest) samt ved mikrobuljongfortynning (BMD) ved bruk av EUENCF MIC plate (Sensititre, Thermo Fisher). Resultatene ble lest av på K-res, men også evaluert av EUCAST Development Laboratory (EDL) i Växjö.
Resultater
Disk diffusjons soner avlest på K-res ble sammenlignet med resultatene i NORM 2019. Vår reanalyse på K-res viste kun ett E. faecalis isolat med nedsatt følsomhet for tigesyklin (18 mm på BD og 19 på Oxoid). Isolatet var også rapportert med nedsatt følsomhet til NORM (19 mm sone). De resterende E. faecalis-isolatene hadde mm soner på 21-25 mm (Figur 1). Alle E. faecalis isolatene ble vist å være tigesyklin følsomme ved bruk av gradienttester og BMD (MIC 0,06-0,25 mg/L) (Figur 3).
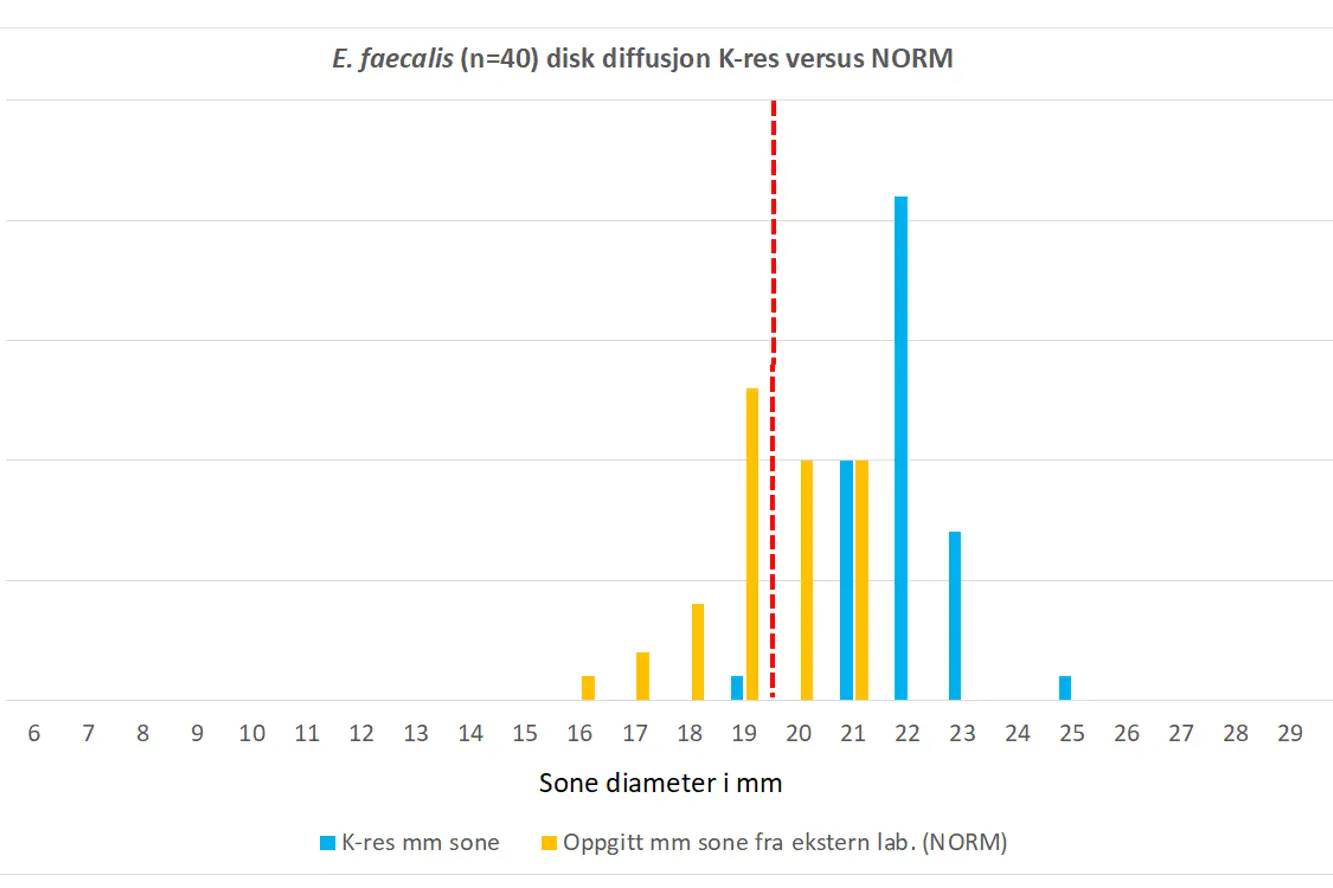
Figur 1. Sammenligning av K-res avleste disk diffusjon mm soner for tigesyklin på E. faecalis NORM 2019 isolater med verdier innmeldt til NORM. Brytningspunkt (R < 20 mm) indikert med rød stiplet strek.
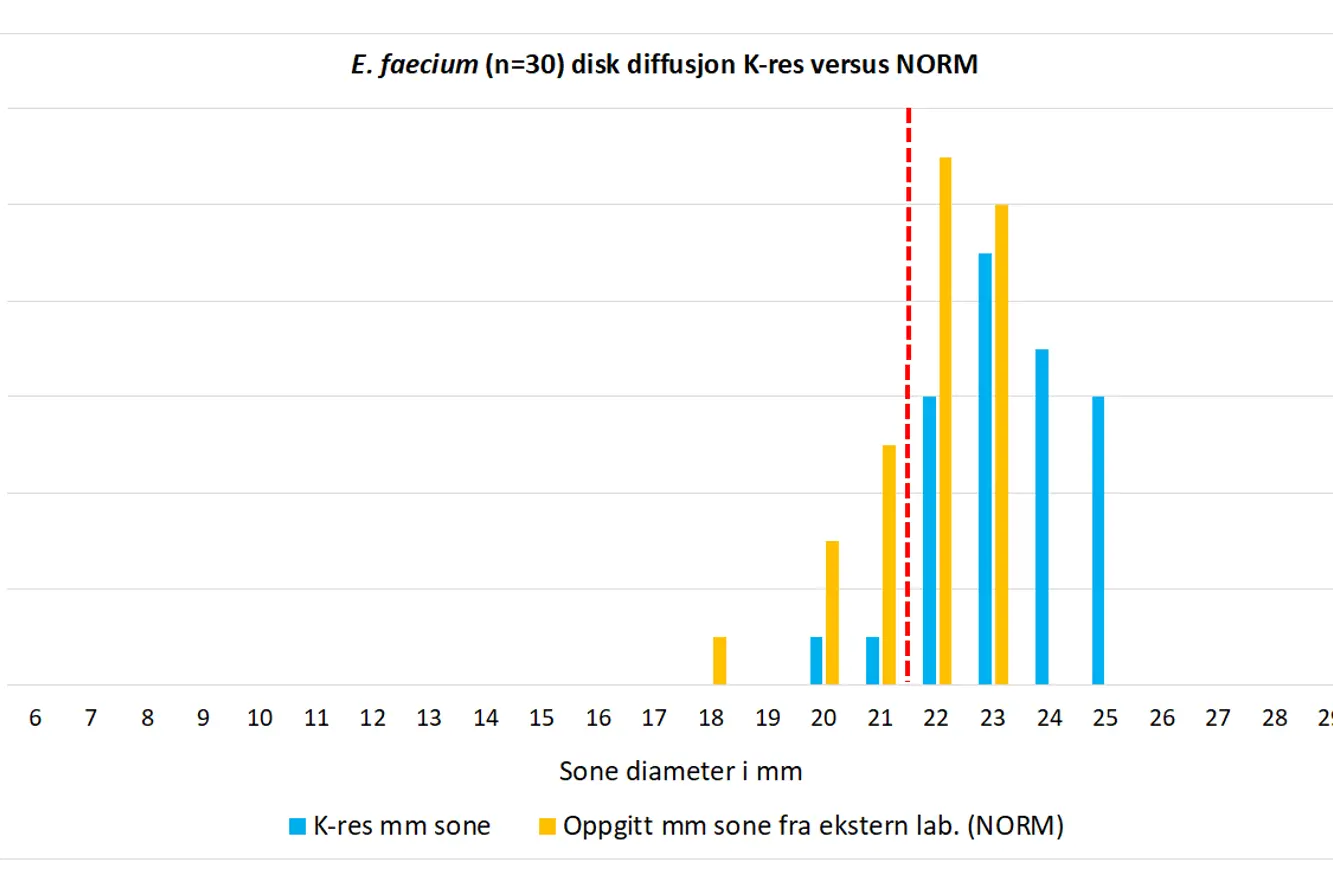
Figur 2. Sammenligning av K-res avleste disk diffusjon mm soner for tigesyklin på E. faecium NORM 2019 isolater med verdier innmeldt til NORM. Brytningspunkt (R < 22 mm) indikert med rød stiplet strek.
To
E. faecium isolater rapportert som henholdsvis resistent og følsomt for tigesyklin til NORM ble på K-res avlest med mm soner under brytningspunktet (21 og 20 mm). De resterende isolatene hadde mm soner på 22-25 mm
(Figur 2). Alle
E. faecium isolatene ble vist å være tigesyklin følsomme ved bruk av gradienttester og BMD (MIC 0,06-0,25 mg/L) med unntak av ett isolat som ble rapportert som følsomt til NORM som viste MIC 0,5 mg/L på Etest
(Figur 4).
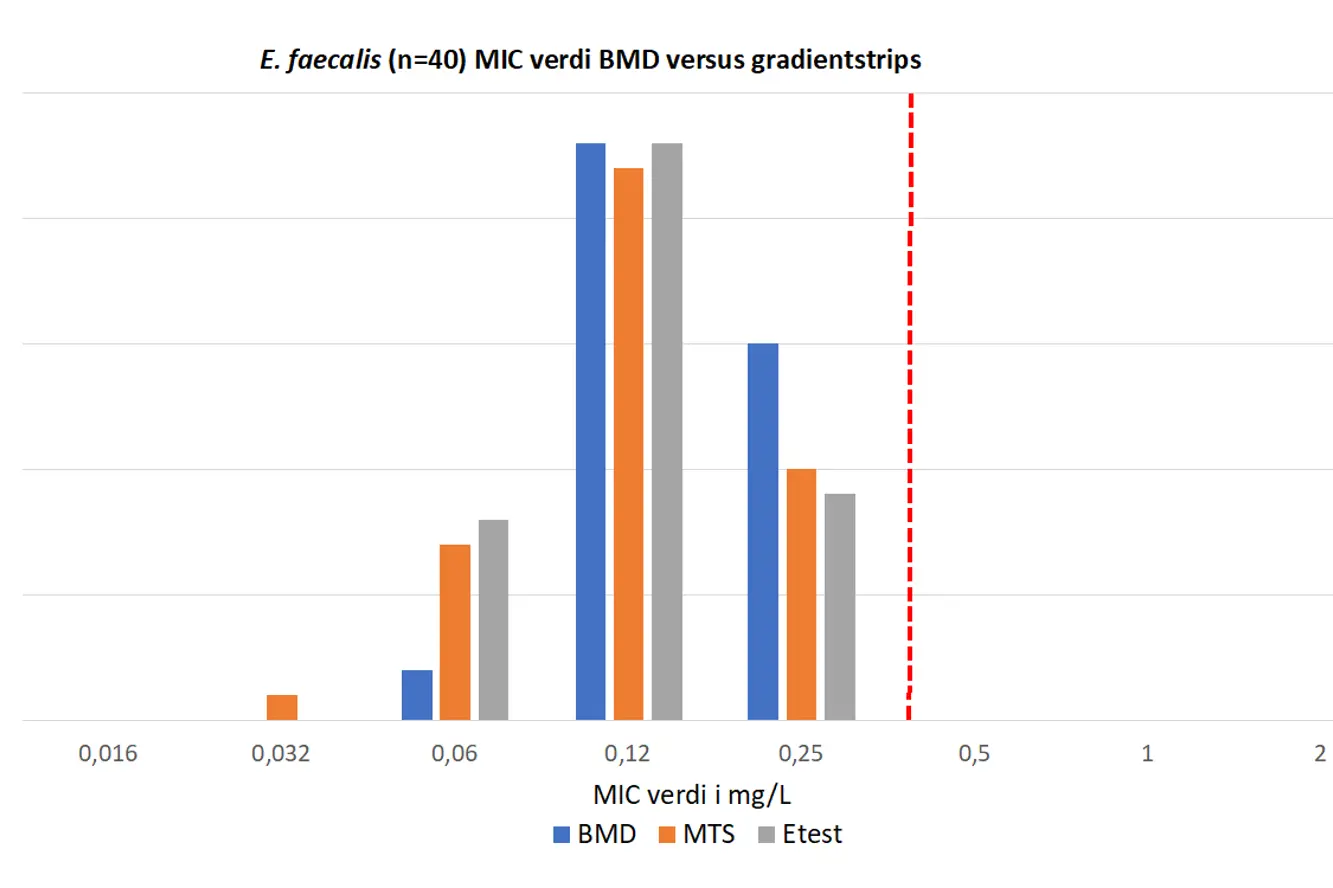
Figur 3. MIC verdier for tigesyklin på E. faecalis NORM 2019 isolater. Brytningspunkt (R > 0.25 mg/L) indikert med rød stiplet strek.
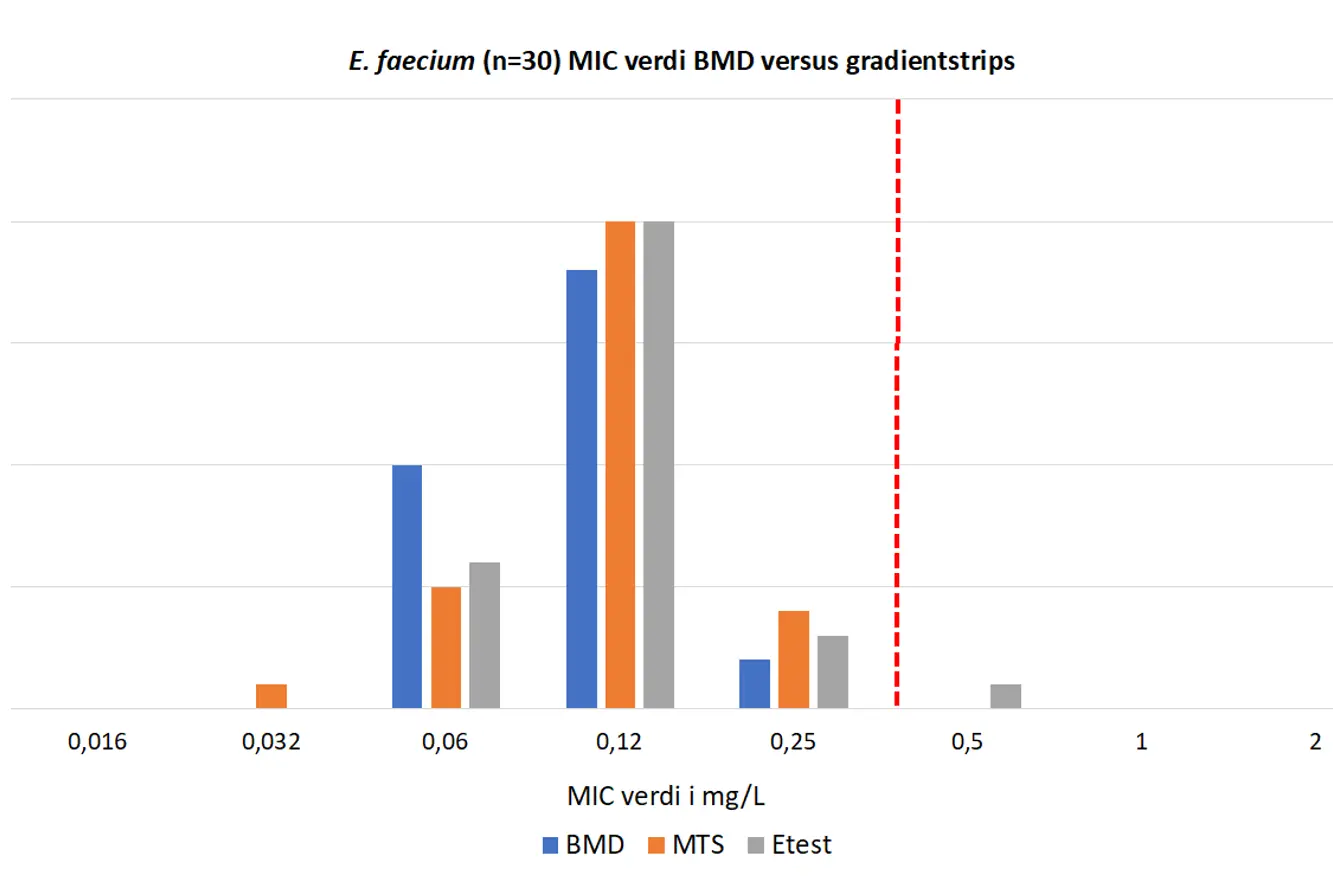
Figur 4. MIC verdier for tigesyklin på E. faecium NORM 2019 isolater. Brytningspunkt (R > 0.25 mg/L) indikert med rød stiplet strek.
EDL kommenterer at mm soner avlest på K-res stemmer bra med sonefordeling for tigesyklin hos EDL og i EUCAST databasen, mens sonene fra de norske laboratoriene ligger lavere. Tigesyklin soner kan være vanskelige å lese av for enterokokker og om man ikke har jevn fin (konfluerende) vekst på platene er det ekstra vanskelig å lese av sonene slik at de leses som mindre enn de skal være.
Det er bra korrelasjon mellom MIC med BMD og disk diffusjon på K-res (Figur 5 og 6), men BMD MIC (Figur 3 og 4) ligger generelt et trinn høyere enn i EUCAST databasen. Dette skyldes delvis at QC-verdien for E. faecalis ATCC 29212 og tigesyklin ligger noe høyt på EUENCF panelet.
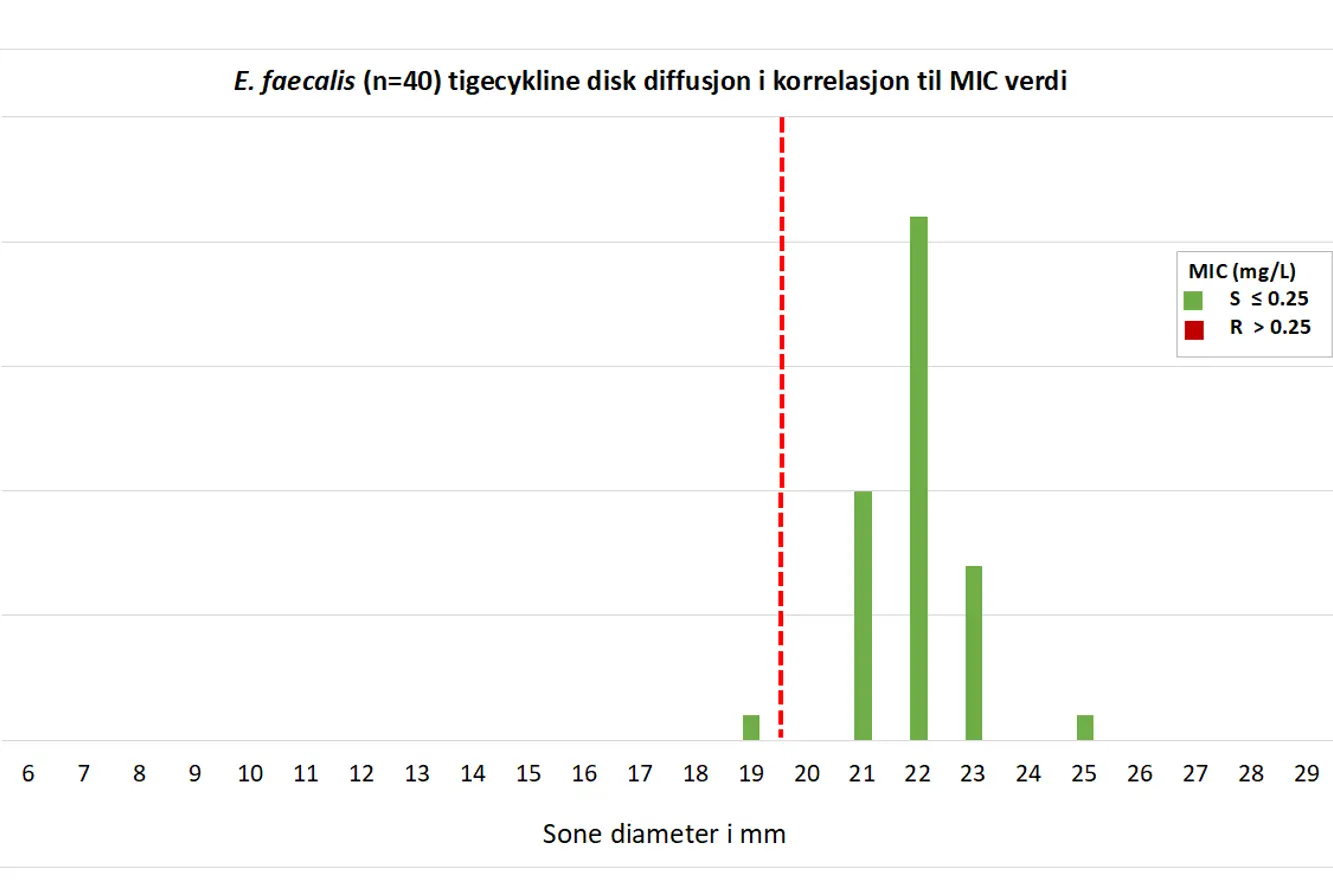
Figur 5. Korrelasjon mellom disk diffusjon mm sone og kategorisering ved BMD for tigesyklin for E. faecalis NORM 2019. Brytningspunkt (R < 20 mm) indikert med rød stiplet strek.
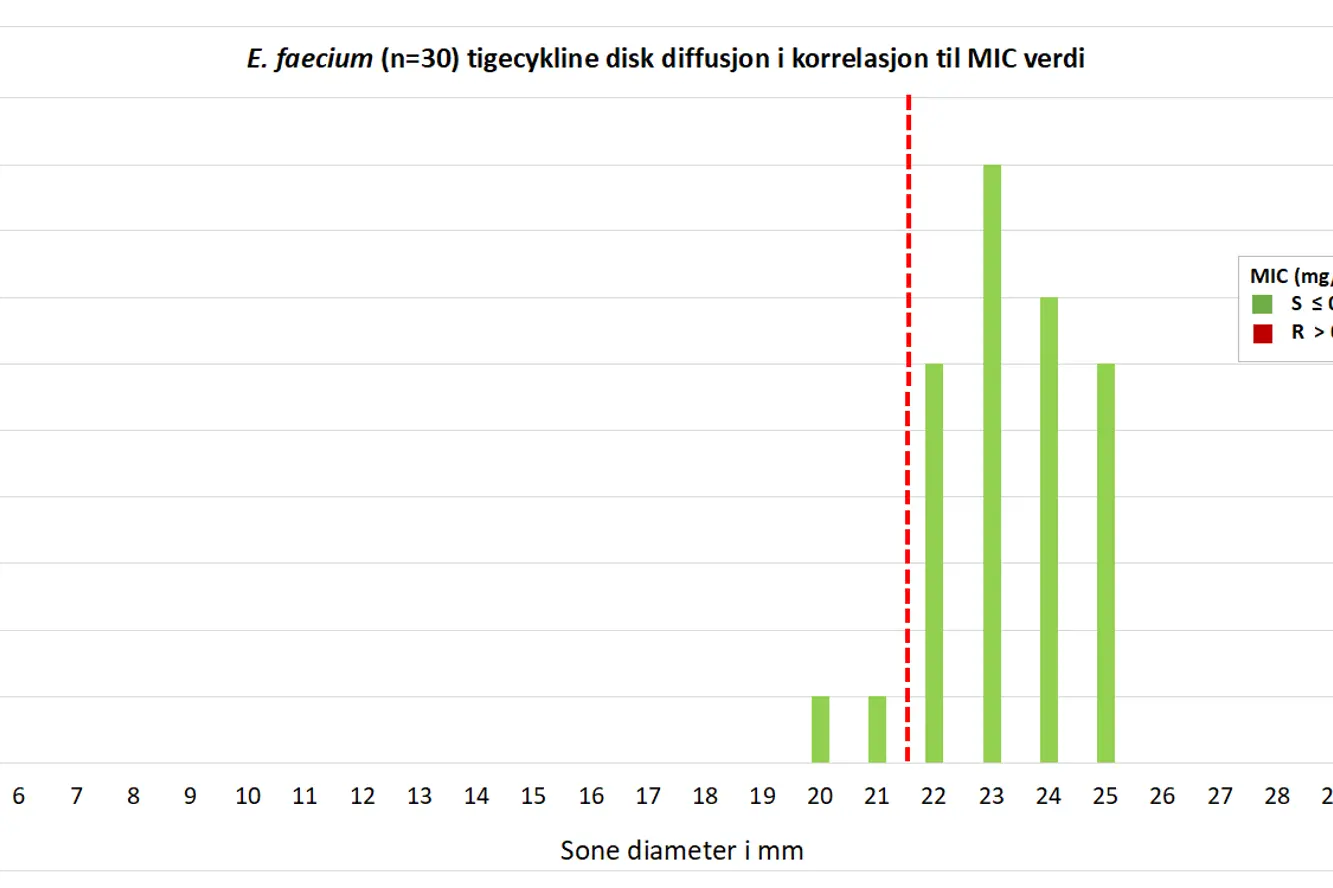
Figur 6. Korrelasjon mellom disk diffusjon mm sone og kategorisering med BMD for tigesyklin for E. faecium NORM 2019. Brytningspunkt (R < 22 mm) indikert med rød stiplet strek.
Konklusjon
Enterokokker rapportert som tigesyklinresistente til NORM 2019 avkreftes å være tigesyklinresistente. Måling av tigesyklin hemningssoner for enterokokker kan være vanskelig. Det er viktig å ha en jevn fin konfluerende bakterievekst. Hvis ikke blir det ekstra vanskelig å lese av sonene. Hemningssonene vil da gjerne avleses som mindre enn de egentlig skal være.
Tusen takk til alle laboratoriene som har bidratt med stammer slik at vi har kunnet gjennomføre denne studien.
Eventuelle spørsmål kan rettes til :